编者按:心房颤动(以下简称“房颤”)是临床常见的心律失常,容易引起卒中或血栓栓塞事件,临床上常给予抗凝药物以预防栓塞,然而抗凝药物治疗的同时会增加出血风险。近年来,左心耳封堵术(LAAC)在非瓣膜性房颤患者卒中预防中显示出潜在的价值。值得注意的是,抗拴治疗贯穿LAAC全程,是LAAC的核心问题之一。针对不同的患者,如何打好围手术期抗凝的基础,预防术后器械表面血栓(DRT)是焦点,也是难点。中国介入心脏病学大会(CIT 2021)中,上海交通大学附属胸科医院何奔教授分享了“左心耳封堵术围术期的抗栓策略”,现小编攫取其精华,与读者共享。
术前抗栓:因人而异,做好基础抗凝!
对于门诊就诊的房颤患者,需常规评估CHA2DS2-VASc。具备抗凝指征的患者,门诊首诊时应立即启动抗凝治疗。对于非瓣膜性房颤患者,如无禁忌症,优先推荐新型口服抗凝剂(NOAC)。同时关注患者是否具有出血高危因素、肝肾功能,有无出血史等情况,警惕出血。
对于入院的房颤患者,术前已接受抗凝治疗者,推荐入院后继续原抗凝方案。同时,动态评估患者的基本情况,服用NOAC者依据活化凝血时间(ACT)调整至标准剂量,服用华法林者依据INR调整。术前未接受抗凝患者,推荐入院后给予起效更快的低分子肝素皮下注射。
手术当日,建议患者均停用抗凝药物。
术中抗栓:适当减量,动态监测ACT!
一般情况下,术前口服抗凝的患者术中减量使用普通肝素(60~100 IU/kg);术前使用低分子肝素的患者,术中使用常规剂量普通肝素(100 IU/kg )。术中动态监测ACT,以维持在250~350s为宜。根据手术时间长短多次监测,必要时追加肝素。
需要注意的是,在术中必须确认穿刺针进入左房后方可使用肝素抗凝,并将ACT控制于250~350s,防止术中导管血栓形成。
术后抗栓:规范管理,预防DRT!
实际上,左心耳封堵术是希望借助封堵器来预防房颤患者发生血栓。但不可忽视的是,封堵器作为一个异物置于慢血流速度的左心房,带来的究竟是治栓 or 致栓?因而,LAAC术后抗栓管理和DRT的预防是LAAC的焦点问题!
LAAC治栓or 致栓?还得看数据!一般来说,封堵器表面血栓发生率约3~4%,属于可接受的范围。但2018年法国一项多中心研究结果非常突出,显示封堵器表面血栓发生率达到7.2%,引起学者们的广泛争议。但深入分析发现,该研究中90%患者有出血史,抗凝禁忌症患者占70%以上,CHA2DS2-VASc评分≥4,而国际上大多数中心基线数据评分仅≥2。也就是说,大多数患者在行左心耳封堵术后,未进行抗凝治疗,这大大增加了DRT的风险。
幸而,左心耳开口位于左上肺静脉的前下方,不会受到来自肺静脉血流的直接冲击。DRT发生后血栓脱落所致的栓塞事件(DRE)发生率极低,多数研究的报道在1%以下。类似于冠脉支架血栓,LAAC术后DRT也是受到患者、手术、器械等相关因素的共同影响,术后规律抗栓是预防DRT的重要一环。
从华法林时代到NOAC时代,术后抗凝策略不断更迭。“华法林时代”中最具代表性的PROTECT-AF、PREVAIL研究奠定了左心耳封堵临床有效的地位。其中,标准化抗凝策略包括术后阿司匹林+华法林45天,经食道超声(TEE)排除DRT后阿司匹林+氯吡格雷DAPT 6个月,TEE排除DRT后维持阿司匹林单药治疗,术后一年随访TEE。
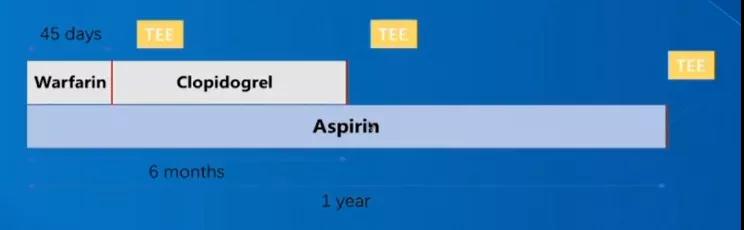
图1. 华法林时代,LAAC术后标准抗凝方案
随着NOAC时代的到来,有学者提出采用NOAC代替华法林。即抗凝方案改为:NOAC+阿司匹林45天,TEE排除DRT后阿司匹林+氯吡格雷(DAPT) 3至6个月,TEE排除DRT后维持阿司匹林单药。或者NOAC+阿司匹林治疗 3至6个月,TEE排除DRT后维持阿司匹林单药[1]。
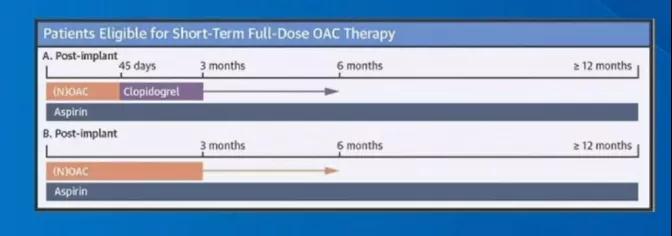
图2. NOAC时代,LAAC术后抗凝方案
对于华法林抗凝不耐受患者,可采用阿司匹林+氯吡格雷治疗1~6个月后维持阿司匹林单药,NOAC+阿司匹林治疗3~6个月后维持阿司匹林单药,或者直接阿司匹林单药治疗[1]。LAAC术后抗血小板治疗的循证医学证据ASAP研究5年随访结果表明:口服抗凝药禁忌的患者行左心耳封堵术后,短期(6个月)接受双联抗血小板治疗安全有效。与CHADS2评分相同但仅服用阿司匹林的人群相比,不良事件显著减少,5年实际缺血性卒中或系统性栓塞(ISSE)的发生率可降低75%[2]。

图3. 华法林抗凝不耐受患者的抗栓方案
真实世界中LAAC术后抗栓策略差异大。Ewolution亚组分析首次从真实世界中汇总差异化用药方案及随访结果,受试者LAAC术后采用了多种抗凝策略,包括DAPT治疗、抗凝治疗、抗血小板单药治疗(SAPT)/未服用任何抗血小板或抗凝药物。研究中,短期(6个月)抗栓中DAPT占比最高,达60%;长期(2年)抗栓中SAPT占比最高,达67%。各亚组初始及长期随访结果显示缺血事件、出血事件K-M曲线无显著差异。尽管,单用抗血小板、未抗凝亚组中,初期出血事件发生率略高,很可能与该组患者基础出血风险高,同时合并多个危险因素有关,而非由于未抗凝或者单用抗血小板药物导致的出血风险增高。
Ewolution亚组分析结果提示真实世界中LAAC术后抗栓策略差异显著,且所有的抗栓方案都表明了较低的缺血性事件发生率。因而,术后抗栓方案及DRT仍是目前LAAC的焦点问题。基于现有的研究结果,可以根据个体化差异量身定制抗栓方案,不必绝对依赖于原有的抗凝抗栓策略。但规范的术后随访非常重要,仍需警惕DRT的产生。
探索更优化的LAAC术后抗栓策略仍在路上。《中国左心耳封堵预防心房颤动卒中专家共识(2019) 》参照PIONEER AF、RE-DUAL、AUGUSTUS等研究结果,提出LAAC术后采用“NOAC+氯批格雷”的联合抗栓方案,提出了基于患者肾功能(用GFR评价)和出血风险(用HAS-BLED评分评价)的个体化抗栓方案[3]。从临床实践结果来看,DRT发生率较前有所降低,出血风险更加可控。
LAAC术后抗栓的热点问题盘点
是否需要关注患者有无氯吡格雷抵抗?尽管有研究报道,氯毗格雷抵抗可能是DRT的危险因素之一;但从现有的注册性研究来看,氯毗格雷抗栓也是行之有效的。对于这类患者,如何选择抗栓方案?单纯抗凝、抗凝+氯吡格雷还是抗凝+阿司匹林/替格瑞洛仍有待进一步的RCT研究予以明确。
塞式vs盘式,不同封堵器抗栓策略是否相同?不同封堵器的内皮化面积存在差异,这是否会影响DRT发生率?动物实验表明对同一左心耳进行封堵显示,Watchman内皮化面积154 mm2、ACP内皮化面积314 mm2 ,Watchman装置内皮化面积更完全,DRT发生率是否更低?同样,Amulet封堵器(盘式)封堵后的残余心耳更小,DRT发生率是否更低? 这些都有待RCT研究进一步明确。此外Watchman-FLX采用内嵌式铆钉设计,理论上可降低DRT风险,这又提出新的问题,新一代封堵器可否酌情降低抗栓强度?
房颤合并冠心病患者,LAAC术后如何抗栓?出血风险不高的患者,术后短期采用三联抗栓;若出血风险高,可以直接采用NOAC+氯吡格雷。
结语
毫无疑问,LAAC是降低房颤患者血栓栓塞风险的有效替代治疗方法。然而,也不可忽视LAAC术后的卒中风险,术后仍应考虑短期抗凝治疗。抗凝药物选择上,NOAC是首选!但不同患者出血风险差异比较大,甚至有些患者可能肾功能不全,无法耐受NOAC,这时可选华法林。
综合来看,基于现有的研究结果,个体化量身定制抗栓方案更优,不必完全依赖原有的抗栓策略。但坚持规范抗栓治疗依然非常重要,有益于患者的远期预后。未来,还需要更多更优的RCT研究探索更优化的抗栓策略。
参考文献:
[1]Saw.J. et al. J Am Coll Cardiol Intv. 2019
[2]D Sharma ot al. JACC 2016.
[3]中华医学会心血管病学分会, 中华心血管病杂志编辑委员会. 中国左心耳封堵预防心房颤动卒中专家共识(2019)[J]. 中华心血管病杂志, 2019, 47(12):937-955.